¿Son débiles los enlaces de hidrógeno?
El enlace de hidrógeno es una fuerza electrostática dipolo-dipolo fija muy fuerte cuando están muchas moléculas unidas, ya que da gran estabilidad, pero más débil que el enlace covalente o el enlace iónico.
¿Es débil un enlace de hidrógeno?
Los enlaces de hidrógeno individuales son débiles y se rompen fácilmente ; sin embargo, ocurren en cantidades muy grandes en agua y en polímeros orgánicos, creando una fuerza mayor en combinación. Los enlaces de hidrógeno también son responsables de unir la doble hélice del ADN.
¿Qué tan fuerte es un enlace de hidrógeno?
Los enlaces de hidrógeno pueden variar en fuerza desde muy débiles (1–2 kJ/mol) hasta extremadamente fuertes (más de 155 kJ/mol) [20]. La longitud de los enlaces de hidrógeno depende de la fuerza del enlace, la temperatura y la presión. La propia fuerza de unión depende de la temperatura, la presión, el ángulo de unión y el entorno.
¿Por qué los enlaces de hidrógeno son los enlaces más débiles?
El enlace de hidrógeno más débil se formará cuando la diferencia de electronegatividad entre el átomo y el H sea mínima . Por lo tanto, S−H−−−−−H forma el enlace de hidrógeno más débil.
¿Cuál es el enlace más débil?
El tipo de enlace más débil son los enlaces de hidrógeno . Los enlaces de hidrógeno se forman cuando un átomo de hidrógeno se une a un átomo más electronegativo. Los enlaces de Hidrógeno tienen la fuerza de atracción electrostática entre las moléculas.
¿El enlace de hidrógeno es fuerte o débil en el agua?
El enlace de hidrógeno del agua es un enlace débil , nunca más fuerte que aproximadamente una vigésima parte de la fuerza del enlace covalente OH. Sin embargo, es lo suficientemente fuerte como para mantenerse durante las fluctuaciones térmicas a la temperatura ambiente y por debajo de ella.
¿Qué es un enlace débil?
Son fuerzas atractivas de rango corto entre grupos químicos que se encuentra en contacto. Se originan debido a pequeños desplazamientos de carga que permiten que los electrones de un átomo sean atraídos por los protones de de otro átomo muy cercano a pesar de que ambos no se encuentren enlazados covalentemente.
¿Por qué el enlace H es el más fuerte?
Los enlaces de hidrógeno son las fuerzas intermoleculares más fuertes para los compuestos covalentes porque tienen los dipolos moleculares permanentes más fuertes de todos los enlaces covalentes . Los tres tipos de enlaces covalentes que califican para el enlace de hidrógeno son los enlaces HF, OH y NH.
¿Qué enlace es el enlace más fuerte?
En química, un enlace covalente es el enlace más fuerte. En dicho enlace, cada uno de los dos átomos comparte electrones que los unen. Por ejemplo, las moléculas de agua están unidas donde los átomos de hidrógeno y los átomos de oxígeno comparten electrones para formar un enlace covalente.
¿Qué enlaces son los más fuertes y los más débiles?
La clasificación de los enlaces más fuertes a los más débiles es: enlace covalente > enlace iónico > enlace de hidrógeno > fuerzas de Van der Waals .
¿Qué son enlaces débiles?
Son fuerzas atractivas de rango corto entre grupos químicos que se encuentra en contacto. Se originan debido a pequeños desplazamientos de carga que permiten que los electrones de un átomo sean atraídos por los protones de de otro átomo muy cercano a pesar de que ambos no se encuentren enlazados covalentemente.
¿Qué son enlaces fuertes y debiles?
Los enlaces carga-carga se dan entre grupos polares y cargados de las cadenas laterales de los AA. Enlace débil que se da entre el extremo de una molécula polar con carga + y otra de carga –. Enlace en el cual, un ion de una sustancia es atraído por los polos de las moléculas covalentes polares.
¿Qué son los enlaces débiles?
Definición. Los enlaces débiles son aquellas fuerzas de atracción que, en situaciones biológicas, no requieren una gran cantidad de energía para romperse . Por ejemplo, los enlaces de hidrógeno se rompen por energías del orden de 4-5 kcal/mol y las interacciones de van der Waals tienen energías de alrededor de 1 kcal/mol.
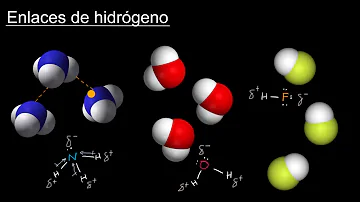
¿Qué tipo de enlace es el hidrógeno?
Los puentes de hidrógeno son un tipo especial de interacción dipolo-dipolo que ocurre entre el par solitario de un átomo altamente electronegativo (típicamente N, O o F) y el átomo de hidrógeno en un enlace N–H, O–H o F–H. Los enlaces de hidrógeno pueden formarse entre diferentes moléculas (puente de hidrógeno …
¿Cómo se le llama a los enlaces muy débiles que no involucran electrones y se forman entre moléculas?
Existen dos tipos de enlaces químicos, los enlaces covalentes (en donde los átomos comparten electrones) y las interacciones débiles no covalentes (interacciones débiles entre iones, moléculas y partes de moléculas). Las fuerzas de Van der Waals, que podemos clasificar a su vez en: ion – dipolo.
¿Cuál es la más fuerte de las fuerzas intermoleculares?
Los enlaces de hidrógeno son el tipo de fuerza intermolecular más fuerte. Se encuentran entre moléculas que contienen un átomo de flúor, oxígeno o nitrógeno, unido a un átomo de hidrógeno.
¿Dónde es más fuerte el enlace de hidrógeno?
As fluorine has small size and high electronegativity, it has high tendency to attract partial positive charge accumulated on H-atom. Entonces, el flúor forma el enlace H más fuerte.
¿Por qué los enlaces de hidrógeno duran poco tiempo?
. ¿Por qué crees que los enlaces H solo duran poco tiempo antes de romperse y reformarse? Estos enlaces de hidrógeno generalmente se consideran débiles, por lo que solo pueden mantenerse durante un breve período de tiempo antes de romperse y tener que reformarse . Además, estos enlaces se rompen debido al calor que se forma debido al movimiento entre varias moléculas de agua.
¿Cuáles son los enlaces débiles?
Dos tipos de enlaces débiles que se ven con frecuencia en la biología son los enlaces de hidrógeno y las fuerzas de dispersión de London. Sin el afán de ser demasiado dramático, pero sin estos dos tipos de enlace, la vida como la conocemos ¡no existiría!
¿Qué es más fuerte un enlace covalente o un puente de hidrógeno?
Un enlace de hidrógeno es una atracción electrostática entre un átomo y la carga positiva de un átomo de hidrógeno unido covalentemente a otra cosa. Es un enlace intermolecular y más débil que un enlace covalente.
¿Cuáles son los enlaces debiles en quimica?
Son fuerzas atractivas de rango corto entre grupos químicos que se encuentra en contacto. Se originan debido a pequeños desplazamientos de carga que permiten que los electrones de un átomo sean atraídos por los protones de de otro átomo muy cercano a pesar de que ambos no se encuentren enlazados covalentemente.
¿Qué tipo de enlace químico es el más fuerte?
Respuesta: es iónico, lo cual es fácil saber ya que se trata de una sal y las sales forman enlaces iónicos. Enlace covalente es el que se forma entre dos átomos por compartición de electrones, procedentes uno da cada átomo, y que ocupan un orbital molecular.
¿Qué enlace forma sustancias duras y frágiles?
Las sustancias covalentes son sólidas, con altos puntos de fusión y de ebullición, debido a la fortaleza de los enlaces covalentes que mantienen unidos a los átomos. Dureza y fragilidad. Las sustancias covalentes son muy duras y no son frágiles ni maleables.
¿Qué enlaces son los más fuertes?
¿Cuál es el enlace químico más fuerte y por qué? – Quora. Este tipo de enlace liene un nombre específico " covalente" sucede cuando los electrones del ultimo nivel de algunos elementos se unen para compartir un compuesto estable llamado "octal" ( por ej. carbono e hidrógeno), el cual supera con creces al enlace ionico.
¿Cuánto dura un enlace de hidrógeno?
Distancias de enlace de hidrógeno
Para los enlaces de hidrógeno, la distancia entre los átomos donantes y aceptores suele ser de 2,7 a 3,3 Angstroms . Las interacciones hidrofóbicas (enlaces de van der Waals) tienen distancias carbono-carbono un poco más largas, generalmente 3.3-4.0 Angstroms.
¿Cuál de las fuerzas intermoleculares es la más débil?
La fuerza de dispersión es la más débil de todas las IMF y la fuerza se rompe fácilmente. Sin embargo, la fuerza de dispersión puede volverse muy fuerte en una molécula larga, incluso si la molécula no es polar.
