¿Qué es la ley Aufbau?
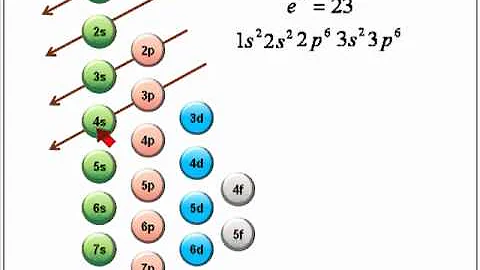
El principio de Aufbauprincipio de AufbauEl principio de Aufbau establece que los electrones no serán ocupados en niveles superiores de energía hasta que los orbitales menos energéticos hayan sido ocupados. Así pues, contiene una serie de instrucciones relacionadas con la ubicación de electrones en los orbitales de un átomo.https://es.wikipedia.org › wiki › Principio_de_AufbauPrincipio de Aufbau – Wikipedia, la enciclopedia libre establece que los electrones llenan los orbitales atómicos de menor energía antes de llenar los de mayor energía (Aufbau es una palabra en alemán que significa "construir"). Si seguimos esta regla, podemos predecir las configuraciones electrónicas para átomos o iones.
¿Cómo se aplica el principio de Aufbau?
El principio de Aufbau establece que los electrones no serán ocupados en niveles superiores de energía hasta que los orbitales menos energéticos hayan sido ocupados. Así pues, contiene una serie de instrucciones relacionadas con la ubicación de electrones en los orbitales de un átomo.
CachedSimilar
¿Cuál es el significado de Aufbau?
Aufbau es un término que se utilizó en publicaciones de 1919 a 1947 en alemán. El término puede traducirse como "estructura", "construcción" o como "reconstrucción", "reconstrucción" .
¿Cómo se llama el principio de Aufbau?
El Principio Aufbau (también llamado principio de acumulación o regla de Aufbau) establece que, en el estado fundamental de un átomo o ion, los electrones llenan orbitales atómicos del nivel de energía más bajo disponible antes de ocupar niveles de energía más altos.
¿Cuáles son las cuatro reglas básicas del principio de Aufbau?
En átomos/iones con dos o más electrones, la configuración electrónica del estado fundamental (1) minimiza la energía total de los electrones, (2) obedece el principio de exclusión de Pauli, (3) obedece la regla de Hunds de máxima multiplicidad y (4) considera la interacción de intercambio .
¿Qué elementos violan el principio de Aufbau?
Por lo tanto, Cu, Cr, Ag no siguen el principio de Aufbau.
¿Cuáles son las excepciones a Aufbau?
Excepciones al Principio de Aufbau
Las subcapas semillenas tienen repulsiones electrón-electrón más bajas en los orbitales , lo que aumenta la estabilidad de los átomos en la subcapa. Además, las subcapas totalmente llenas aumentan la estabilidad del átomo como lo hacen con las subcapas parcialmente llenas.
¿Por qué es cierto el principio de Aufbau?
Por lo tanto, de acuerdo con el principio de Aufbau, un orbital atómico debe llenarse antes de pasar al siguiente, por lo que el orbital atómico puede tener como máximo dos electrones . Por lo tanto, la afirmación dada es verdadera.
¿Qué viola la regla de Hund?
Aquí, en el orbital p , una subcapa está vacía pero una subcapa está doblemente llena o completamente llena . Este tipo de configuración electrónica violaba la regla de Hund.
¿Cuáles son los 7 niveles cuánticos principales?
Conjunto de números cuánticos
| nombre | significado orbital |
|---|---|
| número cuántico principal | shell o capa |
| número cuántico secundario o azimutal (momento angular) | subshell o subcapa |
| número cuántico magnético, (proyección del momento angular) | energía shift |
| número cuántico proyección de espín | espín |
¿Quién inventó el principio de Aufbau?
El principio de Aufbau usa una simple regla numérica para describir la secuencia en la que se llenan los orbitales. Esta se conoce como la regla de Madelung, por el físico Erwin Madelung, quien la formuló en la década de 1930 (Agudelo, 2015).
¿Cómo se obtiene cada uno de los 4 números cuánticos?
Puede tomar los valores enteros positivos: n= 1, 2, 3, 4, 5, 6, 7. Por ejemplo si tengo un elemento químico que su último nivel es el 3s, su número cuántico principal sería el 3. Si tengo un elemento químico en que su último nivel es el 1s, entonces su número cuántico principal sería 1.
¿Cuando no se cumple el principio de Aufbau?
El principio de Aufbau no logra predecir las configuraciones electrónicas de muchos metales de transición y elementos de tierras raras (lantánidos y actínidos). Esto se debe a que las diferencias de energía entre los orbitales ns y (n-1)d son bajas.
¿Quién puede oponer las excepciones?
El demandado utilizará la contestación a la demanda para exponer los fundamentos con los que se opone a las pretensiones de la persona que le demanda y alegará las excepciones procesales que considere pertinentes que pongan de relieve “cuando obste a la válida prosecución y término del proceso mediante sentencia sobre …
¿Qué viola el principio de Aufbau?
Actualizado el: 27-06-2022. El principio de Aufbau se viola en la opción (c) ya que los electrones cambian a orbitales p sin llenar completamente el orbital s que tiene una energía comparativamente más baja .
¿Qué es la regla de la lluvia?
Es el método usado en química para describir la configuración electrónica de los elementos tomando en cuenta su numero atómico. Se usa para ubicar al elemento en la tabla periódica sacando su grupo y periodo.
¿Qué nos dice la regla de Pauli?
El principio de exclusión de Pauli establece que no puede haber dos electrones con todos los números cuánticos iguales.
¿Cuál es el nivel de energía más alto?
Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno, al 7, el más externo.
¿Cuáles son los 4 números cuánticos y que representan?
Luego, los números cuánticos son valores numéricos que describen e indican las características de los electrones de los átomos. Estos números son cuatro y se denominan número cuántico principal (n), número cuántico secundario o azimutal (l), número cuántico magnético (m) y número cuántico de spin (s).
¿Cuáles son los 7 niveles cuánticos?
Conjunto de números cuánticos
nombre significado orbital número cuántico principal shell o capa número cuántico secundario o azimutal (momento angular) subshell o subcapa número cuántico magnético, (proyección del momento angular) energía shift número cuántico proyección de espín espín
¿Cómo se leen los números cuánticos?
El número cuántico principal, n, designa la capa electrónica principal. Debido a que n describe la distancia más probable de los electrones desde el núcleo , cuanto mayor sea el número n, cuanto más lejos esté el electrón del núcleo, mayor será el tamaño del orbital y mayor será el átomo .
¿Qué son las excepciones ejemplos?
Las excepciones son elementos o cuestiones que se apartan de las condiciones más frecuentes. Podría afirmarse, por citar un caso, que a la mayoría de los niños les gustan las golosinas. Los pequeños a quienes no les agradan los dulces, por lo tanto, constituyen una excepción.
¿Qué tipo de excepciones existen?
¿Qué tipos de excepciones procesales existen en el Código de Procedimientos Civiles mexicano?
- Excepciones de pago.
- Excepciones de confusión de derechos.
- Excepción de novación.
- Excepciones de compensación.
- Excepción de condición resolutoria.
- Excepciones de remisión de deuda.
- Excepción de prescripción negativa.
¿Qué significa realmente 40 lluvia?
Si un pronóstico para un condado determinado dice que hay un 40 % de probabilidad de lluvia esta tarde, entonces hay un 40 % de probabilidad de lluvia en cualquier punto del condado desde el mediodía hasta las 6 p. m., hora local .
¿Por qué se llama lluvia?
Inglés medio rein, del inglés antiguo regin "lluvia, descenso de agua en gotas a través de la atmósfera", del protogermánico *regna- (fuente también del sajón antiguo regan, frisio antiguo rein, holandés medio regen, holandés regen, alemán regen, Regn nórdico antiguo, rign gótico "lluvia"), sin ciertos cognados fuera del germánico, a menos que sea …
¿Qué dice la regla de Hund?
La regla de Hund establece que los orbitales de igual energía están ocupados cada uno por un electrón antes de que cualquier orbital sea ocupado por un segundo electrón, y que cada uno de los electrones individuales debe tener el mismo giro.
