¿Por qué los átomos quieren 8 electrones de valencia?
Estas configuraciones electrónicas terminan con 8 electrones en el último nivel de energía, a excepción del helio (He), lo cual permite que estos elementos sean muy estables, por ello cuando los elementos se unen mediante enlace buscan completar 8 electrones en su último nivel para ser estables como lo son los gases …
¿Por qué los átomos tienen 8 electrones?
En definitiva, indica que dos átomos iguales, al enlazarse, desarrollan una organización específica. Al constituirse el enlace por la compartición de los pares de electrones, cada átomo adquiere la estructura de un gas noble. Así, ambos átomos se encontrarán rodeados de ocho electrones en su última capa energética.
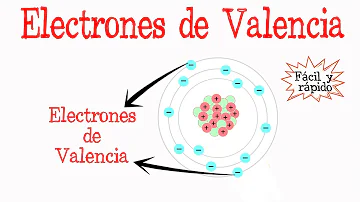
¿Por qué los electrones quieren 8 electrones de valencia?
Ya que todos los gases nobles tienen 8 electrones en su capa de valencia y se observa que son altamente estables e inertes, es decir, no reaccionan con otros elementos . Por lo tanto, la regla del octeto se mantiene con el llenado de 8 electrones en la capa de valencia de un átomo. Los elementos con menos de 8 electrones en la capa de valencia significan menos estables.
¿Qué átomo tiene 8 electrones de valencia?
Todos los átomos de los gases nobles excepto el helio (o sea: neón, argón, criptón, xenón y radón) tienen ocho electrones de valencia.
¿Por qué el átomo quiere completar su octeto?
Los elementos querrían completar su octeto para lograr una configuración de gas estable para que se vuelvan estables .
¿Por qué los átomos quieren un octeto?
Los átomos reaccionarán para ponerse en el estado más estable posible . Un octeto completo es muy estable porque todos los orbitales estarán llenos. Los átomos con mayor estabilidad tienen menos energía, por lo que una reacción que aumenta la estabilidad de los átomos liberará energía en forma de calor o luz.
¿Qué tiene 8 electrones de valencia y una configuración electrónica estable?
La configuración electrónica del neón , un gas noble. El neón tiene un octeto completo de ocho electrones de valencia y, por lo tanto, tiende a no unirse con otros átomos.
¿Qué dos cosas quieren todos los átomos?
Ellos, como todos los átomos, quieren ser felices . Tienen dos posibilidades: pueden intentar llegar a ocho electrones para llenar su tercera capa, o pueden ceder algunos electrones y tener una segunda capa llena.
¿Qué necesitan los átomos para cumplir la regla del octeto?
Cada átomo debe perder o ganar electrones para lograr un octeto. Además, todos los electrones perdidos por un tipo de átomo deben ser ganados por el otro. Una excepción a la regla del octeto ocurre en el caso de los tres iones que tienen la estructura He 1 s 2, es decir, H —, Li + y Be 2 +.
¿Por qué los átomos quieren completar su capa de valencia?
Para lograr una mayor estabilidad , los átomos tenderán a llenar completamente sus capas externas y se unirán con otros elementos para lograr este objetivo compartiendo electrones, aceptando electrones de otro átomo o donando electrones a otro átomo.
¿Solo los átomos con exactamente 8 electrones siguen la regla del octeto?
Sin embargo, existen tres excepciones generales a la regla del octeto: moléculas, como el NO, con un número impar de electrones; Moléculas en las que uno o más átomos poseen más de ocho electrones , como el SF 6 ; y. Moléculas como BCl 3 , en las que uno o más átomos poseen menos de ocho electrones.
¿Por qué los átomos quieren unirse?
¿Por qué formar enlaces químicos? La respuesta básica es que los átomos están tratando de alcanzar el estado más estable (de menor energía) que pueden . Muchos átomos se vuelven estables cuando su capa de valencia está llena de electrones o cuando cumplen la regla del octeto (al tener ocho electrones de valencia).
¿Qué hace que los átomos se mantengan unidos?
Cada átomo está compuesto por un núcleo con protones cargados positivamente y neutrones neutros, y está rodeado por una capa externa llamada nube de electrones, que tiene carga negativa. Las cargas opuestas se atraen tanto dentro del mismo átomo como entre átomos . Esta atracción forma enlaces químicos entre diferentes elementos.
¿Por qué no sigue la regla del octeto?
La primera excepción a la regla del octeto es cuando hay un número impar de electrones de valencia . Un ejemplo de esto sería el Óxido de Nitrógeno (II) también llamado óxido nítrico (NO. El Nitrógeno tiene 5 electrones de valencia mientras que el Oxígeno tiene 6. El total sería de 11 electrones de valencia a utilizar.
¿Que deben hacer los atomos para completar ocho electrones en su capa de valencia?
La regla de octeto o regla del octeto es un postulado que se emplea en el contexto de la química. Se trata de la tendencia que evidencian los átomos de completar su nivel energético con ocho electrones para alcanzar estabilidad. La regla de octeto fue postulada por Gilbert Newton Lewis.
¿Que deben hacer los átomos para completar ocho electrones en su capa de valencia?
Es cuando los átomos forman compuestos al perder, ganar o compartir electrones para adquirir 8 electrones de valencia. El hidrógeno logra la estabilidad del helio, con 2 electrones de valencia. Los átomos de los gases nobles se caracterizan por tener todos sus niveles y subniveles energéticos completamente llenos.
¿Qué átomo tiene 8 electrones?
El oxígeno es un elemento químico de número atómico 8, lo que significa que cada átomo de Oxígeno cuenta con 8 protones en su núcleo atómico.
¿Qué átomos tienen 8 electrones?
Todos los gases nobles tienen ocho electrones en su último nivel (excepto el Helio que tiene dos). Los gases nobles no reaccionan con los otros elementos, por eso se les denomina también gases inertes.
¿Qué mantiene unidos a dos átomos?
El enlace químico se refiere a las fuerzas que mantienen unidos a los átomos para formar moléculas y sólidos. Esta fuerza es de naturaleza eléctrica, y la atracción entre los electrones de un átomo al núcleo de otro átomo contribuye a lo que se conoce como enlaces químicos.
¿Qué nos dice la regla del octeto?
La regla del octeto propuesta por Lewis en 1916 [1], afirma que la capa de valencia de un átomo en una molécula siempre tiene ocho electrones, donde cada par de electrones compartidos es contado como contribución completa e igual a la capa de valencia de ambos átomos enlazados independiente de la polaridad de los …
¿Qué pasa si dos átomos se tocan?
Los átomos no suelen permanecer en la naturaleza aislados, sino que tienden a agregarse entre sí formando unas estructuras más complejas. Se unen porque aislados no son estables, y el unirse a otros átomos les permite pasar a una situación de menor energía, lo que supone también mayor estabilidad.
¿Por qué los átomos quieren ser estables?
Los átomos reaccionarán para llegar al estado más estable posible. Un octeto completo es muy estable porque todos los orbitales estarán llenos . Los átomos con mayor estabilidad tienen menos energía, por lo que una reacción que aumenta la estabilidad de los átomos liberará energía en forma de calor o luz.
¿Qué átomos violan la regla del octeto?
¿Qué elementos pueden ser una excepción a la regla del octeto? No hay suficientes electrones en el hidrógeno, el berilio o el boro para formar un octeto. Solo hay un electrón de valencia en el hidrógeno, y solo hay un sitio para que se conecte con otro átomo.
¿Qué dice la regla del octeto o regla de los ocho?
La regla del octeto propuesta por Lewis en 1916 [1], afirma que la capa de valencia de un átomo en una molécula siempre tiene ocho electrones, donde cada par de electrones compartidos es contado como contribución completa e igual a la capa de valencia de ambos átomos enlazados independiente de la polaridad de los …
¿Qué determina que un átomo debe tener ocho electrones en su entorno para adquirir la configuración electrónica estable de un gas noble?
La regla de octeto o regla del octeto es un postulado que se emplea en el contexto de la química. Se trata de la tendencia que evidencian los átomos de completar su nivel energético con ocho electrones para alcanzar estabilidad. La regla de octeto fue postulada por Gilbert Newton Lewis.
¿Qué elementos tienen 8 electrones de valencia?
Cualquier elemento del grupo 18 tiene ocho electrones de valencia (excepto el helio, que tiene un total de solo dos electrones). Los ejemplos incluyen neón (Ne), argón (Ar) y criptón (Kr).
